- Indice:
- Che cos'è un ecosistema?
- Cosa si intende per microbiota e microbioma intestinale?
- A ogni persona il suo "habitat" di batteri
- Una microflora variata
- Come cambia il microbiota nel corso della vita?
- Come si modifica il microbiota in età adulta
- Perché è importante conoscere e rispettare l'ecosistema intestinale?
- Eubiosi e disbiosi
- Microbiota e salute: una relazione decisiva, soprattutto nelle donne
- Microbiota e cervello
- Microbiota e cibo
- Che cosa sono i probiotici, i prebiotici e i simbiotici?
- Come scegliere il trattamento più adeguato?
- Conclusioni
- Approfondimenti specialistici
Che cos'è un ecosistema?
Un elemento fondamentale degli ecosistemi è che sono dinamici. Non esiste un equilibrio statico, ma solo equilibri temporanei che sono in continua evoluzione.
Se varia una delle componenti, le altre ne risentono; se alcune forme di vita muoiono, altre proliferano.

Cosa si intende per microbiota e microbioma intestinale?
Per microbioma invece si intende l’insieme del patrimonio genetico e delle interazioni ambientali della totalità dei microrganismi che colonizzano il nostro tratto digerente e che costituiscono nel complesso il microbiota.
A ogni persona il suo "habitat" di batteri
Delle circa mille specie di microrganismi identificati (i più numerosi dei quali sono batteri, e in misura inferiore miceti e virus), ogni essere umano ospita almeno 160 specie (Ottmann 2012).
Il microbiota è davvero unico e può essere considerato una specie di "carta d'identità": ogni persona ha un suo habitat di batteri.
Una microflora variata
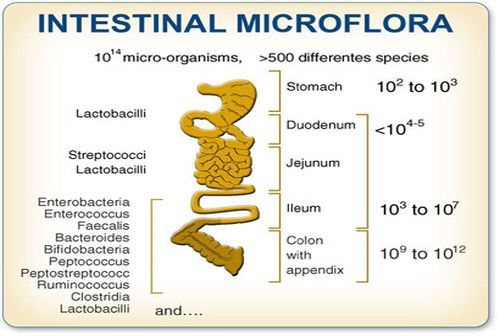
Ogni porzione del tratto gastro-intestinale infatti è colonizzata da una microflora specifica. La quantità e la complessità del microbiota aumentano progressivamente lungo il tratto gastro-intestinale: si passa da poche centinaia di batteri nello stomaco fino ad arrivare a 10¹⁴ nel colon (Donaldson 2016).
In base alle sue caratteristiche, ogni specie batterica colonizza preferenzialmente un piccolo tratto del tubo digerente. In generale, possiamo considerare che specie batteriche aerobiche tenderanno a colonizzare il tenue e le prime porzioni di colon, mentre via via che si scende nelle porzioni più distali del colon troveremo batteri anaerobi, più o meno stretti o facoltativi (molti sopravvivono in assenza di ossigeno e alcuni ne tollerano la presenza), che costituiscono la maggior parte del microbiota del sistema digerente.
Batteri della stessa specie possono svolgere funzioni molto diverse, e addirittura all’interno della stessa specie possiamo ritrovare ceppi molto patogeni e ceppi assolutamente salutari (si veda, più avanti, il caso dell’Escherichia coli Nissle 1917).
Come cambia il microbiota nel corso della vita?
Nei primi 4-36 mesi di vita, a seguito del contatto con i genitori, l’ambiente esterno e il cibo, il microbiota si sviluppa cambiando rapidamente. Ecco perché qualsiasi intervento sulla flora batterica in questa età (sia in positivo che in negativo) assume un significato importantissimo in quanto lascerà un segno indelebile su quello che sarà il microbiota dell’adulto (una specie di imprinting).
Da tale nucleo di base individuale varie modifiche continuano a osservarsi nei diversi stadi della vita o se si instaurano particolari condizioni patologiche.
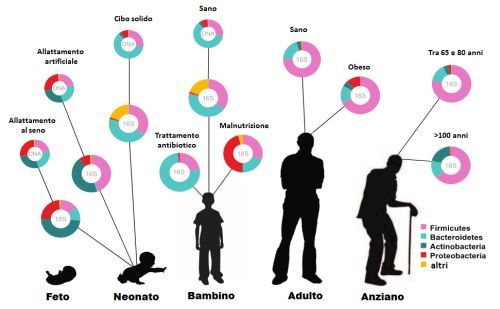
Come si modifica il microbiota in età adulta
Tali modificazioni, però, sono molto più lente. In età adulta infatti ogni persona ha un proprio, specifico, individuale, personale microbiota che tende a rimanere identico nel tempo. In questa fase, ogni intervento esterno sulla composizione batterica porterà esclusivamente a una modifica transitoria del microbiota, che tenderà poi a tornare alla sua composizione originale.
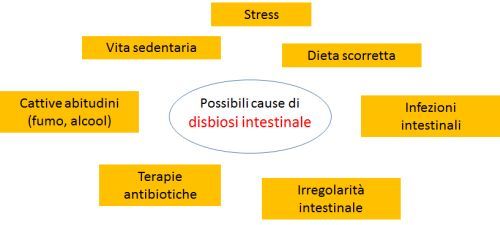
Perché è importante conoscere e rispettare l'ecosistema intestinale?
Il microbiota dovrebbe essere considerato come un vero e proprio organo metabolico squisitamente convertito alla nostra fisiologia, che si occupa di funzioni che non siamo in grado di svolgere altrimenti.
Tali funzioni includono la capacità di assimilare componenti altrimenti indigeribili della nostra dieta, sintetizzare alcune vitamine indispensabili, disgregare e detossificare sostanze che il nostro organismo non è in grado di smantellare, regolare l’espressione del sistema immunitario (di cui, non a caso, il 70% risiede nell’intestino), proteggere la mucosa intestinale dall’attacco di specie patogene.

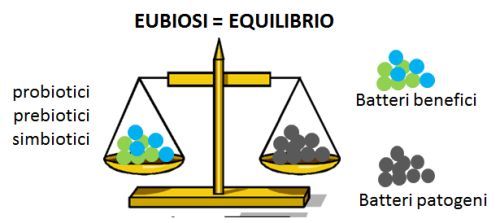
Eubiosi e disbiosi
Al contrario, la rottura di questo equilibrio (disbiosi) è all’origine di molti stati patologici, non solo a carico del sistema digerente: intestino irritabile, stipsi o diarrea, infiammazioni intestinali (Sartor 2008), ma anche malattie legate alla sfera immunologica, allergie, patologie autoimmuni, sovrainfezioni batteriche che possono essere la fonte di infezioni recidivanti ricorrenti dell’apparato urinario (cistiti, vaginiti, prostatiti), patologie metaboliche (insulino-resistenza, ipercolesterolemia, obesità) (Ridaura 2013), insufficienza renale cronica (Koeth 2013) e persino disturbi comportamentali e dell’umore (irritabilità, depressione, autismo) (Toh 2015; Hsiao 2013).
Microbiota e salute: una relazione decisiva, soprattutto nelle donne
E’ vero che noi donne abbiamo, più degli uomini, un “cervello viscerale”, ossia una centrale neurovegetativa ed emozionale di risposta al mondo situata nell’intestino. Oltre il 90% della serotonina, che è il neurotrasmettitore principe che regola il tono dell’umore, non si trova nel cervello ma nella parete dell’intestino (El Aidy 2016). Ecco perché la pancia esprime bene il nostro umore e il nostro stress!

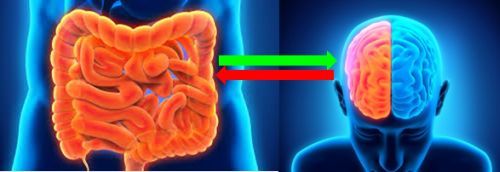
Microbiota e cervello
- a piccole quantità, componenti dei batteri stimolano il nostro sistema immunitario innato, e questo è ottimo;
- purtroppo, proteine dei germi possono creare reazioni crociate con antigeni umani e causare seri problemi nel nostro sistema immunitario: molte intolleranze, allergie alimentari e malattie autoimmuni hanno questa base;
- i batteri possono produrre sostanze neurotossiche, come l’azoto e il D-acido lattico: un cervello intossicato e infiammato pensa malissimo;
- i batteri possono anche produrre ormoni e neurotrasmettitori, che influenzano il cervello, ma rispondono anche ai nostri ormoni e alle loro fluttuazioni. Il che spiega meglio il gonfiore di pancia (meteorismo) premestruale, nonché la depressione e l’irritabilità associate, o la tendenza progressiva alla stitichezza dopo la menopausa.
Gli antibiotici sono bombe atomiche per il microbiota: per tornare alla normalità possono non bastare due anni. Ecco perché bisogna usarli con prudenza e visione clinica a lungo termine.
Microbiota e cibo
Da qui l’idea di poter intervenire sul nostro stato di salute ripristinando condizioni di equilibrio eventualmente compromesse attraverso un’alimentazione funzionale e una terapia microbica specifica che faccia uso di probiotici con differenti azioni (usati come singoli ceppi o in combinazione tra loro), prebiotici e simbiotici.

Che cosa sono i probiotici, i prebiotici e i simbiotici?
Per definirsi “probiotico” un microrganismo deve essere sicuro per l’impiego nell’uomo ed essere in grado di:
- raggiungere l’intestino in forma attiva e vitale;
- persistere e moltiplicarsi per colonizzare la mucosa;
- conferire un beneficio fisiologico specifico e dimostrato.
La colonizzazione intestinale da parte dei probiotici ha carattere temporaneo e termina alcuni giorni dopo la sospensione della loro assunzione.
I prebiotici, invece, sono sostanze di origine alimentare non digeribili che sono utilizzate come nutrimento dalla flora intestinale e che promuovono selettivamente la crescita e/o l’attività di uno o più batteri già presenti nel tratto intestinale (autoctoni) o assunti contestualmente al prebiotico.
La proliferazione selettiva di batteri salutari non comporta solo un miglioramento dell’assetto e dell’equilibrio della flora colica, ma stimola anche la produzione di sostanze come gli acidi grassi a catena corta (SCFA) che svolgono un ruolo fondamentale per assicurare il corretto apporto di nutrienti e la corretta funzionalità delle cellule intestinali, contribuendo a mantenere l’intestino in buona salute.
I principali prebiotici sono, per esempio, i frutto-oligosaccaridi (FOS), l’inulina, il lattulosio, gli oligosaccaridi della soia.
Come tra noi esseri umani c’è chi preferisce il dolce al salato, la pasta alla bistecca, così ogni ceppo batterico avrà un “cibo” preferito che gli permetterà di crescere meglio di altri.
L’uso congiunto di probiotici e prebiotici porta allo sviluppo di alimenti definiti “simbiotici”.
Come scegliere il trattamento più adeguato?
Se si vuole risolvere una situazione di disbiosi generalizzata (ad esempio dopo una diarrea intensa o dopo una terapia antibiotica), sarà consigliabile ricorrere a un simbiotico, il quale agirà sia a livello del tenue (apportando uno o più ceppi probiotici, generalmente lattobacilli e bifidobatteri) che a livello del colon (dove i prebiotici stimoleranno la crescita sia dei probiotici che dei batteri salutari autoctoni) garantendo così il più ampio e completo riequilibrio della flora batterica di tutto l’intestino.
Se abbiamo bisogno di intervenire con un’azione specifica su una specifica porzione del tratto intestinale, invece, dovremo scegliere un probiotico monoceppo.
Un esempio molto interessante è quello dell’Escherichia coli Nissle 1917. Nonostante questo batterio appartenga alla famigerata famiglia degli Escherichia coli, non soltanto non è patogeno come molti altri ceppi della stessa specie tristemente noti, ma è l’unico di fatto in grado di contrastare direttamente ed efficacemente i suoi “fratelli” patogeni (Mohsin 2015).
Questo, innanzitutto, perché si localizza nelle stesse porzioni di intestino (colon distale), competendo con loro per i nutrienti e la colonizzazione della mucosa. L’azione di Escherichia coli Nissle 1917, però, non si limita a questo: esso infatti potenzia la sua azione antibatterica in maniera sia diretta, tramite la produzione di batteriocine, che indiretta, comunicando con le cellule della mucosa intestinale che in risposta producono altre sostanze battericide (defensine) (Wehkamp 2004). Escherichia coli Nissle 1917 è anche in grado di rafforzare le giunzioni tra le cellule dell’epitelio colico (Zyrek 2007), riducendo efficacemente la “sindrome dell’intestino che perde” (leaky gut syndrome), responsabile di molte patologie anche a declinazione allergica, autoimmune e ginecologica (Lopetuso 2015). Infine, Escherichia coli Nissle 1917 possiede straordinarie proprietà immunomodulanti che, tramite la riduzione delle citochine pro-infiammatorie e la stimolazione di quelle anti-infiammatorie (Helwig 2006), gli permettono di funzionare da antinfiammatorio naturale, efficace ma privo di effetti collaterali.
Per le sue azioni caratteristiche e specifiche, Escherichia coli Nissle 1917 è quindi il probiotico di elezione in tutti i casi di infiammazione del colon, come diverticolite e colite ulcerosa, e di infezioni da E. Coli patogeni, anche recidivanti, come enteriti e cistiti ricorrenti (Storm 2013).
Conclusioni

Approfondimenti specialistici
- El Aidy S et al, Microbiome to Brain: Unravelling the Multidirectional Axes of Communication, Adv Exp Med Biol, 2016
- Helwig et al, Lactobacilli, bifidobacteria and E. coli nissle induce pro- and anti-inflammatory cytokines in peripheral blood mononuclear cells, World J Gastroenterology, 2006
- Hsiao EY et al, Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders, Cell, 2013
- Koeth RA et al, Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis, Nature Medicine, 2013
- Lopetuso LR, Scaldaferri F et al, The therapeutic management of gut barrier leaking: the emerging role for mucosal barrier protectors, Eur Rev Med Pharmacol Sci, 2015
- Mohsin M. et al, Probiotic Escherichia coli Nissle 1917 reduces growth, Shiga toxin expression, release and thus cytotoxicity of enterohemorrhagic Escherichia coli, International Journal of Medical Microbiology, 2015
- Ottmann N et al, The function of our microbiota: who is out there and what do they do?, Front Cell Infect Microb, 2012
- Ridaura VK et al, Gut microbiota from twins discordant for obesity modulate metabolism in mice, Science, 2013
- Sartor RB, Microbial influences in inflammatory bowel diseases, Gastroenterology, 2008
- Storm DW et al, Editorial comment, The Journal of Urology, 2013
- Toh MC, Allen-Vercoe E, The human gut microbiota with reference to autism spectrum disorder: considering the whole as more than a sum of its parts, Microb Ecol Health Dis, 2015
- Wehkamp J et al, NF-kappaB- and AP-1-mediated induction of human beta defensin-2 in intestinal epithelial cells by Escherichia coli Nissle 1917: a novel effect of a probiotic bacterium, Infection and Immunity, 2004
- Zyrek AA et al, Molecular mechanisms underlying the probiotic effects of Escherichia coli Nissle 1917 involve ZO-2 and PKCzeta redistribution resulting in tight junction and epithelial barrier repair, Cellular Microbiology, 2007
Link correlati:Ecosistema gastrointestinale e salute della donna Cervello viscerale: un formidabile regista della nostra salute
Parole chiave:
Alimentazione
Cervello / Sistema nervoso centrale
Cervello viscerale / Sistema nervoso enterico
Eubiosi e disbiosi
Intestino
Microbiota intestinale
Probiotici, prebiotici e simbiotici





 CERCA NEL SITO
CERCA NEL SITO








 - 02.jpg)





